コンテンツ
卵巣抑制療法は、エストロゲン受容体陽性の閉経前乳がんに使用できる治療法です。再発のリスクを減らすためにタモキシフェンまたはアロマターゼ阻害剤と一緒に、または転移性乳がんが腫瘍の成長を遅らせるために、早期乳がんとともに使用されることがあります。化学療法を受けている女性の生殖能力を維持するために、卵巣抑制療法が使用されることはあまりありません。卵巣抑制療法は永久的(卵巣の外科的除去による)または一時的(薬物の使用による)のいずれかです。最も一般的な副作用は、のぼせ、気分のむら、膣の乾燥など、作成される一時的または永続的な閉経に関連しています。長期的には、骨粗しょう症から心臓病までの潜在的なリスクを考慮する必要があります。
最近のガイドラインでは、治療(タモキシフェンまたはアロマターゼ阻害剤と組み合わせた場合)が再発リスクの低下と生存率の改善の両方に関連しているため、再発リスクが高い女性に対する卵巣抑制療法の使用がより重視されています。
閉経前乳がん
卵巣抑制療法は、エストロゲン受容体陽性の乳がんの閉経前女性にのみ使用されます。閉経前の女性の乳がんは、卵巣がエストロゲンを産生し続け、エストロゲンがこれらの腫瘍の燃料として作用するため、治療が困難な場合があります。
問題は小さくありません。乳がんの約3分の1が50歳未満の女性で診断されています。これらの腫瘍のうち、2020年の研究レビューでは、約80%がエストロゲン受容体陽性であることが示されています。
閉経前乳がんの治療に関する課題は、潜在的な利益と潜在的なリスクの両方に及びます。閉経前の女性は一般に、年配の女性より予後が悪く、初期段階の腫瘍ではより積極的な治療法を模索すべきであることを示唆しています。
これらの癌が再発すると、遠隔部位で再発することがよくあります。これは、腫瘍がステージ4または転移性乳癌になったことを意味します。転移性乳がんのおよそ90%から94%は、実際には以前の初期の乳がんの遠隔再発です。
ステージ4では、これらのがんはもはや治癒可能ではなく、長期生存者もいますが、転移性乳がんの生存率の中央値は約3年です。 40歳未満の女性の再発のリスク(つまり、死亡のリスク)は、40歳以上の女性の1.5倍とさらに高くなっています。
方程式の反対側では、閉経前の女性は治療の長期的な副作用のリスクが高いだけでなく(生活の多くが治療に先行しているため)、ホルモン治療に伴う一般的な副作用は忍容性が良い。卵巣抑制療法で発生する突然の更年期症状は、自然に更年期に入った女性の症状が徐々に発症するのとは異なります。
生理が止まっても閉経前かもしれません
多くの人々は、非常に若い人でさえ、化学療法後に閉経前であると聞いて混乱することに気づきます。化学療法はそれ自体が卵巣抑制療法の一種であり、大部分の女性にとって、治療期間は終了します。
卵巣機能は若い女性ほど回復力があり、若い女性は化学療法後のある時点で月経を再開する可能性が高くなります。
40歳以上の女性では、化学療法による卵巣抑制は永続的である可能性が高く、これは、高齢の女性の生存率の向上と関連していると考えられています。とはいえ、女性がもはや生理を持たず、自然閉経の年齢に近づいても、まだ閉経前である可能性があります。
閉経前か閉経後か(60歳未満の場合)を確実に知る唯一の方法は、血液検査を行うことです。卵胞刺激ホルモン(FSH)の検査だけではなく、エストラジオールテスト。
さらに、血液検査に基づく化学療法後に閉経後の状態であっても、これは変化する可能性があります。卵巣機能の再活性化は、特に卵巣機能を刺激する可能性のあるアロマターゼ阻害剤で懸念されており、多くの医師は一時的な卵巣抑制を選択した人の更年期状態について血液検査を監視することを推奨しています。
FSHとエストラジオールの血液検査(超高感度検査)は、化学療法後に月経がなくなったとしても、本当に閉経後かどうかを知るために必要です。
用途
卵巣抑制療法は新しい治療法ではありません。実際、これは100年以上前に進行性乳がんの女性に使用された最初の全身性(全身)治療でした。古い研究では、卵巣抑制療法は閉経前の女性のエストロゲン受容体陽性乳がんの化学療法と同じくらい効果的であることがわかっています(ただし、これに代わるべきではありません)。
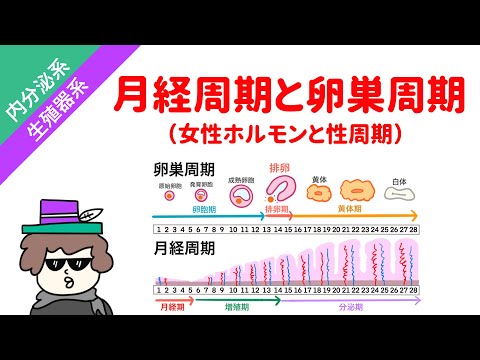
エストロゲン受容体陽性の乳がんでは、卵巣で産生されるエストロゲンは、がんの成長を促進する燃料のように機能します。卵巣抑制療法は、さまざまな方法で卵巣を閉鎖し、エストロゲンを産生しないようにします。がんの治療には主に3つの用途があります。
早期乳がんの再発リスクを軽減
卵巣抑制療法は、エストロゲン受容体陽性乳がんの閉経前女性の再発リスクを下げるために、タモキシフェンまたはアロマターゼ阻害薬と組み合わせて使用できます。
組み合わせの潜在的な利点は、人の年齢、がんの病期、腫瘍の悪性度(がんの侵攻性)、リンパ節の関与などによって異なり、一部の女性ではかなりの利益が得られ、他の女性ではリスクが上回る場合があります利点(以下で説明)。
卵巣抑制療法は、もう一方の乳房に2番目の原発性乳がんを発症するリスクも低減するようです。
転移性乳がん
卵巣抑制療法は、転移性乳がんの閉経前の女性に使用できるホルモン療法の1つの要素です。
生殖能力を維持するには
あまり一般的ではありませんが、卵巣の抑制は化学療法の有害な影響からの保護を提供する可能性があるため、化学療法中に卵巣抑制療法が使用されることがあります。
方法
卵巣抑制療法は、外科的または永久的な選択肢である放射線アブレーションを介して、または通常は一時的な薬物療法を介して行うことができます。
外科的卵巣抑制療法
卵巣抑制療法の外科的処置は、両側卵管卵巣摘除術(BSO)です。この手順では、卵巣と卵管の両方が除去されます。卵管はエストロゲンを分泌しませんが、多くの卵巣癌は卵管から発生すると考えられているため、卵巣とともに除去されることがよくあります。
外科的処置は3つの異なる方法で行うことができます。
- 腹腔鏡下BSO: 腹腔鏡手術では、ほとんどの場合、腹部に3つの小さな切開が行われ、管と卵巣は特別な器具で除去されます。これは通常、同日手術として行われます。腹腔鏡手術は侵襲性は低くなりますが、できない場合もあります(たとえば、人が以前の腹部手術からの瘢痕組織(腹部癒着)をたくさん持っている場合など)。
- ロボットBSO: ロボット手順は、腹腔鏡BSOに似ていますが、手順はロボットの助けを借りて行われます。
- 開腹術とBSO: 開腹術では、下腹部(ビキニライン)を切開し、卵巣を手動で取り出します。
放射線アブレーション
手術や投薬よりも使用頻度が低いため、卵巣機能を抑制するために放射線アブレーションが使用されることがあります。利点は、手術の方が手術よりも侵襲性が低いことですが、一部の女性では卵巣の抑制が不完全になることがあります。血液検査は、効果が持続することを確認するために必要です。
医療卵巣抑制療法
卵巣抑制は、卵巣にエストロゲンを分泌するように指示する下垂体/視床下部からの信号を妨害することによっても達成できます。ホルモン(ゴナドトロピン刺激ホルモン)を月1回注射で投与すると、下垂体によるゴナドトロピンの分泌が減少します(ダウンレギュレーション)。
この下垂体による黄体形成ホルモン(LH)と卵胞刺激ホルモン(FSH)の放出の減少は、エストロゲンとプロゲステロンを生成する卵巣への信号を減少させます。この刺激がなければ、卵巣は本質的に休眠状態になります。
ゴナドトロピンホルモン(GnRH)アゴニストと呼ばれる薬には、
- ゾラデックス(ゴセレリン)
- Trelstar、Decapeptyl Depot、またはIpssen(トリプトレリン)
- ルプロン(ロイプロリド)
GnRHアゴニストは、毎月または3か月ごとに注射で投与されますが、中止すると、卵巣抑制は元に戻ります。
別のGNRHアゴニストであるFirmagonも臨床試験で評価されています。従来のGnRHアゴニストは一部の人々(以下を参照)で抑制を維持できない可能性があるため、特にアロマターゼ阻害剤と組み合わせると、他のオプションが評価されています。
臨床試験では、アロマターゼ阻害剤レトロゾールと組み合わせると、Firmagonがより迅速な反応を引き起こし、サイクル1以降も維持されることがわかりました。対照的に、トリプトレリンは注射を使用した人の15.4%で卵巣抑制を適切に維持しませんでした。
一時的なオプションと永続的なオプション
外科的/アブレーション(永久的)またはより一時的な医療卵巣抑制療法のいずれかを選択するかは非常に個人的なものであり、考慮すべき多くの問題があります。
子供を産むという将来の欲求: 確かに、もしあなたが将来妊娠することを望んでいるなら、一時的な選択肢が好まれるでしょう。
可逆性: 非常に若い女性の場合、腫瘍学者はリバーシブルであるため、医学的な卵巣抑制療法から始めることをしばしば勧めます。このようにして、副作用が許容できない場合は、投薬を単純に中止することができます。治療が十分に許容される場合は、外科的処置を後日行うことができます。
遺伝性乳がん/バイエルンがん: 遺伝性乳がん/卵巣がんの患者さん(BRCA変異や卵巣がんのリスクを高めるその他の変異を持っている人など)は、特に将来妊娠したいと思わない場合は、永久的な選択肢が望ましい場合があります。
研究によると、BRCA変異があり乳がんの女性の場合、卵巣の除去により、すべての原因による死亡率が70%低下し、乳がんによる死亡リスクが60%低下しました(この効果は主にBRCA1変異がある(BRCA2変異ほどではない)、卵巣摘出術が乳がんの診断から2年以内に行われた場合)
現在の遺伝子検査ではすべての遺伝性がんを検出することはできないため、遺伝子検査が陰性であっても決定を下す際には、卵巣がんの家族歴も考慮する必要があります。遺伝カウンセラーと話すことはあなたのリスクを評価するのに役立つかもしれません。
副作用とリスク: 薬物療法とは異なり、手術のリスクには、麻酔の合併症、出血、感染症などがあります。
効果: 早期乳がんの卵巣抑制に対する手術と投薬の有効性を比較する確かな研究は現在ありませんが、2つのアプローチは転移性乳がんの人々で類似しているように見えました。
ただし、特に太りすぎの女性では、医学的な卵巣抑制が不十分または一貫性がなく、結果として効果が低くなる可能性があるという懸念があります。これは、アロマターゼ阻害剤(逆説的に卵巣を刺激する可能性があります)でも治療される女性にとって大きな懸念事項です。
卵巣抑制療法が早期乳癌の閉経前の女性の生存率を改善できることを示す臨床試験の1つでは、一部の女性が抑制が不十分であり(血液検査に基づく)、16%後に手術または放射線アブレーションを受けました。このため、医学的アプローチを選択した場合、医師は超高感度ホルモン血液検査であなたの血中ホルモンレベルを監視することがあります。
再発を減らすための卵巣抑制
転移性(ステージ4)の乳がんの女性の約94%が最初に早期乳がんと診断され、その後再発したため、再発のリスクを減らす方法を検討することは、早期乳がんの女性にとって重要です。再発のリスクを検討する場合、最初の5年間の再発のリスクだけでなく、長期的なリスクを検討することが重要です。
卵巣抑制療法は、診断時に50歳未満の女性の無再発生存率と全生存率を向上させることが明らかになっています。
とはいえ、乳がんの閉経前の女性の中には、他の女性よりも卵巣抑制療法の恩恵を受ける可能性が高いようです。これは、リスクと副作用に対する治療の利点を比較検討する際に重要です。いくつかの臨床研究(SOFTおよびTEXT試験を含む)は、誰が最も恩恵を受けるかを絞り込むのに役立ちました。
卵巣抑制療法は、エストロゲン受容体陽性乳がんの50歳未満の女性の全生存率を明らかに改善することができます。しかし、一部の女性は他の女性よりもはるかに利益が高く、リスクと副作用が低リスクのがんの女性の利益を上回る可能性があります。
現時点では、卵巣抑制は、ステージIIおよびIIIの乳がんのほか、再発リスクが高い一部のステージIのがんなど、再発のリスクが高い女性で最もよく考慮されます(人化学療法が推奨されるだろう)高腫瘍グレードなど。
これまでの研究を検討する場合、タモキシフェンとタモキシフェンの併用療法と、アロマターゼ阻害剤との併用療法と卵巣抑制療法の使用法を比較することは役に立ちます。
卵巣抑制プラスタモキシフェン対タモキシフェン単独
タモキシフェンのみで治療された閉経前の女性とタモキシフェン+卵巣抑制療法の併用を比較すると、2015年の研究では、併用は女性全体に利益をもたらさないことが判明しました。
とはいえ、化学療法が推奨され、閉経前の女性である場合、この組み合わせは大きな利益をもたらしました。これは特に若い女性(たとえば35歳未満)の間で顕著でした。ヒト上皮成長因子2陽性の腫瘍を有する人々のサブグループは、併用療法から最大の利益を得るようでした。
化学療法を受けた女性では、タモキシフェンに卵巣抑制療法を追加すると、再発、二次乳がん、または死亡のリスクが22%低くなります。
35歳未満の女性では、タモキシフェンのみを使用している女性では67.7%、タモキシフェン+卵巣抑制を受けた女性では78.9%、アロマターゼ阻害剤+卵巣投与を受けた女性では83.4%でした。抑制。このグループでは、タモキシフェンのみを受けた人々の3分の1が5年間で再発(55%離れた)を経験しましたが、併用グループの6分の1と比較されました(ただし、5年後の再発も考慮する必要があります)。
2020年の研究は、タモキシフェンのみに比べて卵巣抑制療法をタモキシフェンに組み合わせると、無病生存期間と全生存期間の両方を大幅に改善するという点で、これらの発見をさらに支持しました。
卵巣抑制:タモキシフェン対アロマターゼ阻害剤
閉経前の女性の場合、卵巣抑制療法を使用しない限り、アロマターゼ阻害薬ではなくタモキシフェンを使用する必要があります。タモキシフェンは、乳がん細胞のエストロゲン受容体に結合することで機能し、エストロゲンが結合できない(成長を刺激できない)ようにします。
対照的に、アロマターゼ阻害剤は、副腎のアンドロゲンのエストロゲンへの変換をブロックすることによって機能します(アロマターゼと呼ばれる酵素による)。閉経前の体内でのエストロゲンの最大の供給源は卵巣ですが、閉経後は、この末梢のアンドロゲンの変換によるものです。
閉経を誘発することによる卵巣抑制療法は、閉経前の女性がアロマターゼ阻害薬を服用することを可能にします。閉経後の女性では、アロマターゼ阻害剤はタモキシフェンと比較して5年後の乳癌の再発防止(後期再発)に30%効果があり、5年後の死亡リスクを15%減少させるようです。
研究により、高リスクの閉経前女性では、アロマターゼ阻害剤がタモキシフェンよりも好ましい可能性があることが示唆されています。さらに、タモキシフェンとのいくつかの薬物相互作用があり、一部の女性にとって投薬を困難にする可能性があります。
現在のアロマターゼ阻害剤は次のとおりです。
- アロマシン(エキセマスタン)
- アリミデックス(アナストロゾール)
- Femara(レトロゾール)
卵巣抑制療法をタモキシフェンまたはアロマターゼ阻害剤と組み合わせる利点は、腫瘍の病期と他のいくつかの特徴に依存します。
前述の2015年の研究では、卵巣抑制療法とタモキシフェンの併用により、再発、二次がん、または死亡のリスクが28%減少し、卵巣抑制とアロマシンの併用により34%の減少が示されました。
タモキシフェンとアロマターゼ阻害剤の選択晩期再発のリスクを下げる
多くの研究が乳がんの5年生存率に焦点を当てていることは注目に値します。しかし、エストロゲン受容体陽性の乳がんでは、いつでも再発が起こる可能性があります。
実際、再発のリスクは残っています 安定しました 少なくとも20年間(診断後5年間ホルモン療法を受けている女性の間で)。これは、腫瘍が診断から14年後に、診断から4年後に再発する可能性が高いことを意味します。初期のエストロゲン受容体陽性腫瘍は実際に もっと 再発する可能性が高い 後 診断後の最初の5年間より5年間
概して、エストロゲン受容体陽性腫瘍が診断後5年から20年の間に再発(遠隔再発)する可能性は10%から41%以上であり、これらの腫瘍を持つ人々は残りの人生の危険にさらされています。お使いになること
化学療法は、診断後の最初の5年間の再発リスクを減らすのに非常に役立ちますが、晩期再発への影響ははるかに少なくなります。対照的に、タモキシフェンまたはアロマターゼ阻害剤によるホルモン療法は、晩期再発の軽減に役立つ可能性があります。これは、これらの薬剤による治療期間が5年を超えて延長されることがある理由の一部です。
2018年の研究によると、エストロゲン受容体陽性、HER2陰性の乳癌を有し、再発のリスクが高い閉経前の女性は、卵巣抑制療法を受けている場合、8年間で遠隔再発のリスクが10%から15%低くなる可能性があります。
そして、いくつかの証拠は、卵巣抑制の生存利益が最大20年間続くことを示唆しています。
ホルモン療法の選択肢についての意思決定を支援する可能性がある晩期再発リスクの計算機があります。
エストロゲン受容体陽性の早期乳がんの女性では、がんは診断後の最初の5年間よりも5年間で再発する可能性が高くなります。ホルモン療法と組み合わせた卵巣抑制療法は、この晩期再発のリスクを下げる可能性があります(少なくとも20年まで)。
乳がんの後期再発卵巣抑制療法はどのくらいの頻度で使用されますか?
卵巣抑制療法は乳がんの閉経前の一部の女性にメリットがあることを知っているので、この療法がどのくらいの頻度で使用されているのか疑問に思われるかもしれません。 2019年の研究では、2014年以降、卵巣抑制療法の使用が増加しており、ホルモン療法に加えて、全体の約25%の女性が卵巣抑制を受けていました。
卵巣抑制を受けた人のうち、30%以上がタモキシフェンではなくアロマターゼ阻害剤を組み合わせて選択しました。この研究はまた、卵巣抑制に関連する生存の利益を見出しました。
卵巣抑制療法に関するガイドライン
American Society of Clinical Oncologyは、乳がんの閉経前女性の治療に関するガイドラインを発表しています。これらのガイドラインは、最新の研究に基づく提案であり、絶対的な規則ではないことに注意してください。がんに関しては、一般的なガイドラインでは考慮されていない多くのニュアンスがあります。
一般に、化学療法が推奨されるII期またはIII期の乳がんの閉経前の女性は、卵巣抑制療法を受けるべきです。また、再発のリスクが高いI期乳がんの一部の女性にも治療を提供する必要があります(この場合は化学療法も推奨されます)。
対照的に、化学療法が推奨されないステージIの乳がんの女性、または腫瘍がリンパ節転移陰性で直径1センチメートル(cm)以下の女性は、卵巣抑制療法を受けるべきではありません。
再発のリスクが高い人、たとえばリンパ節陽性またはより大きな腫瘍の女性では、再発リスクがさらに低下するため、タモキシフェンよりもアロマターゼ阻害剤の使用が検討される場合があります。
しかし、アロマターゼ阻害剤を開始する前に、女性は閉経後であることを確認するために超高感度エストラジオール血液検査を行う必要があり、手術による永久的な卵巣抑制が選択されない限り、これを定期的に繰り返す必要があります。
転移性乳がんの有効性
転移性乳がんの潜在的な治療法を評価するときは、治療の目標が初期がんとは異なることを知ることが重要です。初期の乳がんでは、最終的には治療が目的です(主に再発リスクを減らすことによる)。現在、転移性乳がんは不治です。このため、治療の目標は生存期間を延長し、生活の質を改善または維持することです。
閉経前の女性の場合、卵巣抑制療法の有効性を、生活の質を低下させる副作用と比較検討する必要があります。
閉経前の乳がんの女性に関する以前のレビューでは、卵巣抑制療法(LHRHアゴニスト)とタモキシフェンを併用すると、全生存期間が改善することがわかりました。早期乳がんのタモキシフェンよりもアロマターゼ阻害剤の利点を考えると、これは同様に有益かもしれません。
不妊治療における有効性
GnRHアゴニストを用いた卵巣抑制療法は、受胎能をある程度維持する可能性がありますが、 ない 胚または卵の凍結による不妊保存のための代替品または代替品。
ある研究では、卵巣抑制療法を受けた女性は妊娠する可能性がほぼ2倍でしたが、その数は少ないままでした(10.3%)。これがどのように機能するかは正確にはわかっていませんが、卵巣内の卵の保護、卵巣への血流の減少、またはその他のメカニズムに関連している可能性があります。
(早発卵巣不全の可能性を減らすために)不妊治療に使用される場合、化学療法が始まる少なくとも2〜4週間前に卵巣抑制療法が開始され、化学療法の期間中継続されます。女性は常に胚または卵の保存を同時に考慮することを勧められるべきです
不妊治療:卵、精子、胚の保護リスクと副作用
他の医療と同様に、卵巣抑制には副作用だけでなくリスクも伴います。課題は、乳がんの若い女性(特に非常に若い女性)が卵巣抑制の恩恵を受ける可能性が最も高いことですが、治療の副作用に悩まされる可能性も高くなります。
一般的な副作用
卵巣抑制療法の最も一般的な副作用は、閉経の一時的または永続的な誘発によるものです。外科的または強制的な閉経では、これらの症状は通常、自然な閉経が徐々に始まる場合に見られるよりも劇的です。症状には次のものがあります。
- ほてりと汗
- 膣の乾燥
- 性的関心/性欲の低下
- 不安やうつ病などの気分の変化
- 不妊
タモキシフェンと組み合わせると、これまでの研究のレビューでは、卵巣抑制を追加すると激しいのぼせの発生率が増加するが、気分に大きな影響はないことがわかりました。
副作用は時間とともに改善する可能性があります。 SOFT試験では、卵巣抑制療法とタモキシフェンの併用を受けた女性は、最初の数年間のほてりに悩まされ、60か月でタモキシフェンのみを受けた女性との違いはありませんでした。
性的関心の喪失は6か月で非常に顕著でしたが、24か月以上では存在しませんでした。最初の6か月は睡眠障害がありましたが、その後は衰えました。膣乾燥症は併用療法群で悪化し、研究全体を通じて継続しました。 (対照的に、タモキシフェンのみを受けたグループは、より多くの膣分泌物とかゆみを経験しました。)
卵巣抑制療法の副作用は時間とともに改善する可能性があります。
卵巣抑制とタモキシフェンの組み合わせを使用したグループと比較して、卵巣抑制とアロマターゼ阻害剤(アリミデックス)を投与されたグループは、性的問題、骨/筋肉痛を経験し、骨密度の大幅な減少がありました。
別の試験では、卵巣抑制療法とタモキシフェンの併用を使用したグループの31.3%とタモキシフェンのみを服用したグループの23.7%に、重大な副作用(1〜4のスケールでグレード3)が見られました。これらには、瞬き、発汗、性欲減退、膣の乾燥、不眠症、うつ病、筋骨格症状、高血圧、耐糖能異常(糖尿病)は含まれていませんでした。
卵巣抑制が生活の質に及ぼす影響に関しては、いくつかの研究が混合されており、違いのない研究もあれば、減少した研究もあります。
深刻な副作用
医学的な卵巣抑制療法では、深刻な影響は主に閉経の誘導に関連しています。外科的閉経はまた、出血、感染、麻酔合併症などの手術の一般的なリスクを伴います。
卵巣摘出術のリスクと副作用閉経が骨粗しょう症と関連していることはよく知られており、タモキシフェン単独群の3.5%と比較して、卵巣抑制療法とタモキシフェンの併用を使用した女性の発生率は5.8%でした。
タモキシフェンとは異なり、アロマターゼ阻害剤は骨粗しょう症にもつながる可能性があり、一部の医師は治療とともに骨粗しょう症薬の使用を推奨しています。 (アロマターゼ阻害剤はタモキシフェンと比較して比較的新しいため、長期的な影響についてはあまり知られていません。)
閉経後の女性の場合、現在、初期の乳がんの一部の女性にはビスフォスフォネートが推奨されています。これは、骨損失を軽減するためではなく、再発のリスクが低いためです。ゾメタなどのこれらの薬物は、骨の微小環境を変化させることで作用するため、骨転移が発生する可能性が低くなります(骨に転移したがん細胞が「付着」する可能性が低くなります)。
研究者たちは、卵巣抑制療法とアロマターゼ阻害剤で治療された閉経前の女性もこの治療の良い候補者であるかもしれないと示唆しています。
他の深刻な副作用のリスクはよく知られていませんが、閉経初期は歴史的に心臓病や認知症のリスクの増加と関連しています。
リスクとメリットの比較検討
卵巣抑制療法を開始する前に、潜在的な利益とリスクについて十分に理解することが重要です。いくつかのガイドラインが用意されていますが、これらは提案にすぎません(裏付けされた調査はあります)。女性と乳がんはそれぞれ異なり、乳がんの種類と病期が類似している2人の人は、非常に異なるアプローチから利益を得たり、好む可能性があります。
のぼせを心配する人にとっては、のぼせが乳がんの生存率の向上に関連していることに注意するのは多少の慰めになるかもしれません。
ベリーウェルからの一言
乳がんに卵巣抑制療法が推奨される理由と再発のリスクを理解することが重要です。エストロゲン受容体陽性腫瘍(大多数)の女性の場合、これには後期再発(診断後10、20年)が発生するだけでなく、初期再発(最初の5年間)よりも一般的であることを認識することが含まれます。
自分のリスクを知り、それを治療の潜在的な利点と比較しても、ほてりが消えるわけではありませんが、ほてりが少し許容され、煩わしさが軽減されるだけです。
乳がん再発リスクを軽減するための非医療的方法